ナンセンス突然変異:アミノ酸を指定するコドンが停止コドンに変化すること。
ミスセンス突然変異:ひとつのヌクレオチド中の異なる塩基に置換されること。アミノ酸が1個置換されたタンパク質が産生される。
フレームシフト突然変異:1つまたは2つの塩基対が挿入もしくは欠失して、ずれて翻訳されること。
トリプレットリピート突然変異:3つ組みのヌクレオチドが増幅されること。

Website of Pathology
by Makoto Mochizuki, M.D., Ph.D.
遺伝性疾患では、恒久的なDNAの変異がある。この変異は生殖細胞にも存在し、子孫に伝わって子孫に同様の遺伝性疾患をおこす。親から受け継いだ遺伝子異常は子の全身の細胞に見られることとなる。老化や腫瘍の時にみられる体細胞の遺伝子異常は、子孫には受け継がれない点で遺伝性疾患とは呼ばれない。
遺伝性疾患に関連して、以下のような言葉が定義される。
遺伝性:両親から受け継ぎ次世代へ配偶子を通じて伝えられる病気に用いられる。
家族性:遺伝性とほぼ同じ意味で用いられる。
先天性:生下時から存在した病気に用いられる。いくつかの先天性疾患は遺伝性ではなく、すべての遺伝性疾患が先天的に発症するものではない。
奇形:先天的に肉眼形態上の異常を持っていることを奇形という。遺伝子異常によるものもあるが、胎生時の発生異常によるものが多い。
主な変異パターンは、欠失、置換、挿入、再構成、逆位、転座、反復配列の増加などである。
点突然変異とは、ある1つの塩基が別の塩基に置き換わることである。点突然変異のパターンとして下記のようなものがある。
同義変異:置き換わっても同じアミノ酸をコードしている。
ナンセンス突然変異:アミノ酸を指定するコドンが停止コドンに変化すること。
ミスセンス突然変異:ひとつのヌクレオチド中の異なる塩基に置換されること。アミノ酸が1個置換されたタンパク質が産生される。
フレームシフト突然変異:1つまたは2つの塩基対が挿入もしくは欠失して、ずれて翻訳されること。
トリプレットリピート突然変異:3つ組みのヌクレオチドが増幅されること。

遺伝子疾患は3つのカテゴリーに分けて考えることができる。カテゴリー別に解説する。
(1) 単一遺伝子突然変異による疾患(メンデル遺伝性疾患)
(2) 多要素、多因子遺伝による疾患(糖尿病、高血圧など、遺伝的影響や環境が影響する疾患)
(3) 染色体異常に起因する疾患(染色体の数や構造異常による疾患、大きな単位での遺伝子の構造異常があるということ)
常染色体優性遺伝(2本の染色体のうち1本に異常があっても発症)、常染色体劣性遺伝(2本の染色体のうち2本に異常があると発症)、伴性遺伝疾患(性染色体に異常があるもの。X染色体劣性が多い)の形式が存在する。
常染色体優性。
fibrillin 1(弾性線維の形成に関与する物質)の異常がある。15番染色体15q21に位置するFBN1遺伝子がコードする。弾性線維に異常があるため大動脈瘤形成と解離を起こしやすく、大動脈弁輪拡張をおこすことがある。fibrillin 1の関連の異常だけではなくほかにも異常がある。たとえば、骨格系の異常(リンカーン体型)、両側水晶体の亜脱臼、などがみられる。
膠原線維の欠陥が認められる。6種の亜型が知られる。
[後側彎型]:リシル水酸化酵素の欠陥によるもの。I型,III型の膠原線維同士の正常な架橋構築が阻止されている。常染色体劣性遺伝。
[血管型]:CL3A1遺伝子の突然変異によるもの。III型コラーゲンの合成障害がある。血管や消化管の脆弱性がみられる。常染色体優性遺伝。
[関節弛緩型]:I型プロコラーゲンからコラーゲンへの変換が阻害されるもの。
常染色体優性。
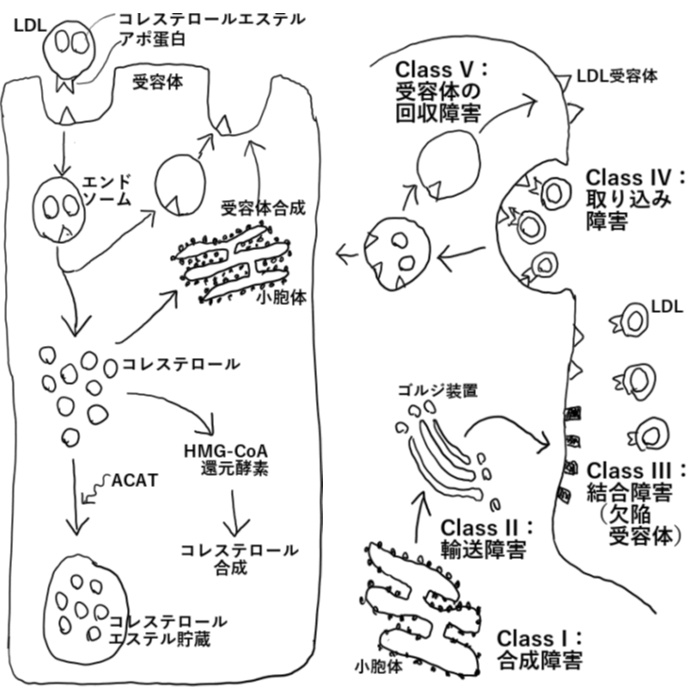
LDL受容体遺伝子(19番遺伝子短腕)の変異がある。LDLの細胞内へ輸送に障害があるため、高LDL-コレステロール血症をひきおこす。
正常では、肝臓で合成されたコレステロールと中性脂肪はVLDLとして血中に分泌される。VLDLはリポタンパクリパーゼによりIDLとなり、更に肝性リパーゼの作用を受けLDLとなる。LDLは末梢組織にてLDL受容体を介し細胞内に取り込まれる。LDLは、エンドソーム内で分解されてコレステロールを分離し、細胞にコレステロールを供給することとなる。血中にある余剰なLDLは肝臓が取り込み回収する。
LDL受容体の異常や欠損があると、細胞がLDLを取り込めなくなり、血中のLDL-コレステロール値が上昇することとなる。
ヘテロ接合(1本の染色体だけ変異がある)の場合、血中LDL-コレステロール値が 軽度に上昇し、30歳で腱の黄色腫が半分の患者に、40歳以前に冠状動脈性心疾患を罹患する患者がが多い。ホモ接合(2本の染色体に変異がある)場合、血中LDL-コレステロール値は非常に高く、小児期から腱の黄色腫と全身の粥状硬化がみられる。無治療では30歳以前に心筋梗塞で死亡する。
肝臓移植による治療が行われることがある。
LDL受容体の障害をおこす遺伝子変異の種類は150以上が知られており、変異の種類によってLDL受容体の機能障害がおこる機序は様々である。Class IからClass Vに分類される。
Class I:LDL受容体の小胞体での合成障害
Class II:LDL受容体の小胞体からゴルジ装置への輸送障害
Class III:LDL受容体のLDLとの結合障害
Class IV:エンドサイトーシス時の取り込み障害(まれ)
Class V:エンドゾーム放出の障害(受容体の再利用ができない)
常染色体劣性
ホモ接合(2本いずれの染色体にも変異がある)の場合、フェニルアラニン水酸化酵素の重度な欠損により、高フェニルアラニン血症とフェニルアラニン尿症となる。生下時には正常である。6ヶ月までに重度の精神発達遅延が現れる。痙攣発作、髪の毛や肌の色素不足(メラニン産生低下)、湿疹などの症状がでる。
フェニルアラニン水酸化酵素の部分欠損では、フェニルアラニン濃度は軽度上昇するのみで神経系症状はでない。治療はフェニルアラニン摂取の制限。ジヒドロプテジリン還元酵素などの酵素欠損でも発症する。
常染色体劣性
ガラクトース-1-リン酸ウリジルトランスフェラーゼの欠損によるガラクトースの代謝障害である。ガラクトース-1-リン酸などの代謝物が多臓器に蓄積する。肝線維化、水晶体混濁(白内障)、脳神経細胞の脱落・脳浮腫などをおこす。治療はガラクトースの摂取制限を行う。
遺伝的にリソソーム酵素が欠損すると不完全に代謝された代謝物がリソソーム内に蓄積する。約40の病気が知られる。
Tay-Sachs病(GM2ガングリオシドーシスB異型)
脳にGM2ガングリオシド(糖脂質)が蓄積する。GM2はヘキソサミニダーゼA(Hex A)のαサブユニット遺伝子突然変異とその酵素欠損による。
ニーマン・ピック病(A,B型)
酸性スフィンゴミエリナーゼの欠損。スフィンゴミエリンが、貪食細胞やニューロンに蓄積する(中枢神経、脾臓、肝臓、骨髄、リンパ節、肺)。[A型]:内臓腫脹と神経学的異常。生後3年以内に死亡。[B型]:内蔵腫脹のみ。
ニーマン・ピック病(C型)
脂肪輸送の根本的欠損により、細胞内にコレステロールが蓄積する。
ゴーシェ病(常染色体劣性)
グルコシルセラミダーゼをコードする遺伝子の突然変異による。グルコシルセラミドが単核貪食細胞に蓄積する(ゴーシェ細胞と呼ばれる特徴的な形態をしめす)。高度な脾腫、肝臓、骨髄、リンパ節にゴーシェ細胞を認める。[I型]:慢性非神経型。99%を占める。[II, III型]:神経徴候を特徴とする。酵素の補充療法が行われる。
ムコ多糖症(常染色体優性、II型は常染色体劣性)
リソソーム内にムコ多糖が蓄積する。I~VII型がある。[I型]:α-L-イズロニダーゼ欠損。デルマタン硫酸とヘパラン硫酸が単球・マクロファージ、線維芽細胞、血管内皮、血管壁の平滑筋細胞、神経細胞に沈着する。[II型(ハンター症候群)]:I型より緩徐な経過をとる。L-イズロン酸スルファターゼの欠損による。デルマタン硫酸とヘパラン硫酸が蓄積する。
大部分が常染色体劣性である。10数種類ある。詳しい一覧表へ
肝型: 肝腫大・腎腫大(グリコーゲン蓄積)と低血糖・高脂血症(グルコース産生不良)。I型糖原病はグルコース-6-リン酸のグルコースへの転換の障害による。フォン・ギールケ病(Ia型)はグルコース-6-ホスファターゼが欠損する。
筋型: 筋線維鞘にグリコーゲン蓄積。運動後の筋攣縮、ミオグロビン尿、血中尿酸値上昇による運動不良。V型糖原病(マックアードル病)は筋ホスホリラーゼの欠損がある。
混合型: II型糖原病(ポンペ病)はリソチーム内の酸性グルコシダーゼ(酸性マルターゼ)の欠損があり、全臓器にグリコーゲンが沈着するが心臓に目立つ。
いくつかの骨格異常、糖尿病、高血圧、痛風、統合失調症、躁うつ病、いくつかの先天性心疾患などがいくつかの遺伝子の組み合わせで、その発症リスクが増加すると考えられている。
染色体の異常には以下のようなパターンがある。
数的異常(正常46本=2n): 倍数体、異数体
構造上の異常: 転座、同腕染色体、欠失(環状染色体)、逆位
多くの場合で染色体疾患は新規に発生する(両親は正常で、兄弟姉妹の発生リスクは低い)(一部例外はある)。
内眼角贅皮、平坦な顔貌、精神発達遅延、心奇形(40%)、易感染性、アルツハイマー病。平均年齢47歳。
後頭部突出、小下顎、耳介低位、精神発達遅延、心奇形、腎奇形、舟底足など。新生児、乳児期に死亡。
小眼球症、口唇口蓋裂、小頭症、精神発達遅延、心奇形、腎奇形、舟底足など。新生児、乳児期に死亡する。
精神発達遅延、小頭症、小下顎をきたす。
精神疾患にかかりやすい。
1) DiGeoge症候群:胸腺低形成(免疫不全)、副甲状腺低形成(低Ca血症)。
2) 口蓋帆心顔症症候群:軽度な免疫不全、顔貌異常、心奇形。
大部分が47XXYである(男性)。男性の性腺機能低下症。精巣萎縮、独特の体系(足が長い)、長身外観。
45Xである(女性)。低身長、二次性徴欠如(索状卵巣)、翼状頸、外反肘、大動脈狭窄。
「トリプレットリピート突然変異」は、3つ組のヌクレオチドの長い反復配列に関連した疾患である。
常染色体優性。
ハンチントン遺伝子内にCAGの反復配列があり、これが過剰に伸びることで発症する。CAGの過伸長によって過剰に産生される蛋白質はポリグルタミンであり、神経細胞の核内、細胞質内に蓄積することによって細胞障害が生じることが知られており、そのような観点から、ポリグルタミン病(polyglutamine disease)ともいわれている。成人期以後に発症する。舞踏様の不随意運動、精神症状、認知症がみられる。
type1とtype2の2種類がある。大部分がtype1である。type1では、19番染色体に存在するミオトニンプロテインキナーゼ(DMPK)遺伝子の3末端非翻訳領域に存在するCTG反復配列が異常に伸長している。反復が35回以下が正常、50回以上が異常とされ、先天型(生下時から症状がでる)では数千以上と非常に増加している。
筋強直現象(手を握った後に素早く開けない、母指球を診察用ハンマーで叩くと持続的な収縮がおこる)がある。首や四肢遠位の筋肉が先行して筋力低下や萎縮をしめす。白内障、耐糖能異常、心障害、西洋斧様顔貌(頬がこける)、前頭部脱毛などをしめす。対症療法がおこなわれる。
ミトコンドリアは独自の遺伝子を持っている。
卵子はミトコンドリアを豊富にもっているのに、精子はほとんどミトコンドリアを持っていない。そのため、母親のミトコンドリア遺伝子が子供に遺伝することになる。母系遺伝という。
ミトコンドリア遺伝子の異常による疾患に、「ミトコンドリア脳筋症」といわれる一群の疾患がある。ミトコンドリアの機能障害で十分な好気的エネルギー産生が行えなくなることによって起こる疾患であり、脳、筋肉、心筋の障害などがみられる。体内や細胞内のミトコンドリアがすべて異常をきたすわけではなく正常なミトコンドリアも存在する。そのため、異常ミトコンドリアを多く含む細胞/臓器が異常を示し、人によりいろいろな症状や病態を示す。
いくつかの遺伝子において、片方の親から受け継いだ遺伝子のみが発現することが知られる。両親のどちらからもらった遺伝子なのかを識別できることをゲノム刷り込みという。
Prader-Willi症候群はゲノム刷り込みに関係する疾患である。
15q11-13領域にある遺伝子(セロトニン受容体かその近傍の遺伝子と考えられる)が発現しないと発症する。この遺伝子は、いつも父親由来の遺伝子のみが発現する。父親の遺伝子に欠陥があると、母親由来の遺伝子が正常でも、Prader-Willi症候群が発症する。
SNRPN遺伝子上流のメチル化可変領域(DMR: differentially methylated region)がメチル化されることで、15q11-13領域にある遺伝子は発現しないようになる。DMRをインプリンティングセンターと呼ぶ。母親由来の遺伝子がメチル化されて発現しないのである。
Prader-Willi症候群は、約75%が欠失(遺伝性疾患とはなるがメンデルの法則には則らない、つまり優性遺伝とか劣性遺伝とかにはならない)でおこる。ただし欠失は突然変異で生じることが多く、兄弟姉妹が発症する危険はほとんどない。約20%が母性片親性ダイソミー(2本の第15染色体が共に母親に由来する状態)でおこる。片親性ダイソミーは、卵子生成時の減数分裂の障害により染色体を2本持つ卵子ができてそれが受精した場合(trisomy rescue)や、染色体のない精子が受精した場合(monosomy rescue)におこる。高齢出産は第一減数分裂の不分離に起因するtrisomy rescue発症リスクとなる。残る少数例は、エピ変異(父由来DMRがメチル化された状態となり機能しなくなるもの)や、稀な小さい欠失やインプリンティング遺伝子変異でおこる。
Prader-Willi症候群の症状は、精神遅滞、低身長、色素低下(顕著な場合は金髪様)、筋緊張低下、肥満、小さな手や小さな足、性器低形成、性格障害、行動異常、など多岐にわたり、かつ年齢に応じて変化する。
間脳にある種々の中枢、食欲中枢(過食、肥満の原因)、呼吸中枢(中枢性無呼吸や昼間の過度の睡眠の原因)、体温中枢(冬場の低体温、夏場の高体温)、情緒の中枢(性格障害との関連)、性の中枢(二次性徴発来不全の一因)などの異常によるものと考えられている。
奇形とは、先天的に肉眼形態上の異常を持っていることを奇形という。形態形成が乱れることによる形態的異常、臓器異常、あるいは解剖学的領域の異常である。形態形成エラーである。
奇形の約50~70%が原因不明、遺伝性が約30~40%、外部環境の影響によるものが約10~15%といわれる。
欠損症、形成不全、低形成、癒合不全奇形、退縮不全、分離不全、閉鎖症、異形成症、異所性などの形成異常が様々な臓器でみられる。
「奇形症候群(malformation syndrome)」とは、発生機序的に関連した多発奇形のことをいう。
胎生時に催奇形物質に曝されることが原因のひとつである。薬剤ではサリドマイド、アルコールなど、感染ではウイルス感染、梅毒などが奇形の原因となる。
受精後18日以前に催奇形物質の影響を受けた場合は出生前死亡となり奇形とはならない。
妊娠3週~8週は胎児の中枢神経、心臓、消化管、四肢などの重要な器官が形成される時期であり、催奇形物質の影響を受けやすく、かつ大きな奇形となりやすい。
妊娠8週以後は重要な器官の形成は終わっているが、中枢神経や生殖器や口蓋などまだ形成中の器官もあり奇形を生じる可能性はゼロではない。
[2020.5.]
[戻る]