Website of Pathology
by Makoto Mochizuki, M.D., Ph.D.
ひとつひとつの病気(患者)には、ひとつひとつの病気(患者)ごとに、障害のでる部位、障害の原因、障害がおこるメカニズム、診断する方法、治療法などがある。ひとつひとつの病気をひとつひとつ覚えていくのは大変なので・・・病気を分類して覚えやすくしようとする試みがなされている。
たとえば、どの臓器に障害がおこる病気か、軽症な病気か死に至る重症な病気か、原因がわかっている病気か原因不明な病気か、効果的な治療がある病気か治療法が確立されていない病気か、病気をおこすしくみ(メカニズム)がわかっている病気かそれが不明な病気か・・・などなど、ひとつの病気はいろいろな視点から分類することが可能なのである。
「病理総論」では、病気をおこすしくみ(メカニズム)を中心に病気を分類し、解説する。
ここで学ぶ、病気をおこすしくみについての基本的知識が、今後、いろいろな病気を理解する助けになるであろう。
古代ギリシャの昔から「種々の疾患は体液の異常が原因である」と信じられてきた。これを「液性病理学」という。その考えに基づき、病気に対して悪い体液や悪い血液を取り除く治療が行われていた。
顕微鏡が発達し、組織や細胞が観察できるようになり、1858年にルドルフ・ウィルヒョウ(Rudolf Virchow)(1821-1902)という病理学者が「細胞病理学(Cellularpathologie)」という本を出版する。

その中で、ウイルヒョウは、「すべての細胞は細胞から発生する」 「すべての生物はどんなに複雑であっても部分である細胞からなりたっており、細胞の異常が疾患を引き起こす」と述べ、「細胞病理学」の基礎を築いたと言われている。
その後、この「細胞病理学」の考えをもとに医学研究が発展した。1865年にメンデルの法則が発表され、遺伝学が生まれる。1876年にコッホが炭疽菌を発見し、コッホの原則を述べ、細菌学が生まれる。その後、DNAの発見などを経て、現在まで、さまざまな病気のしくみがいろいろと解明されてきたのである。
「病理総論」では、病気のしくみを、細胞傷害、循環障害、炎症、組織修復、免疫異常、感染症、遺伝疾患と先天異常、腫瘍、環境による障害に分けて解説する。
「すべての生物はどんなに複雑であっても部分である細胞からなりたっており、細胞の異常が疾患を引き起こす」
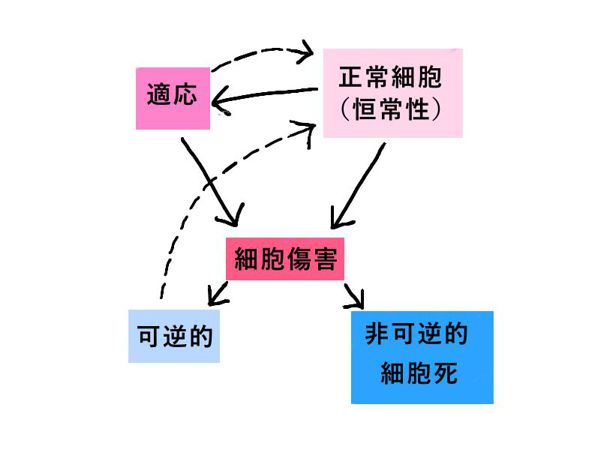
細胞は、正常な状態では「恒常性(homeostasis)」を保って存在している。いろいろなストレスを受けて恒常性を保てなくなると、細胞は「適応(adaptation)」することによって新たな定常状態に移行する。
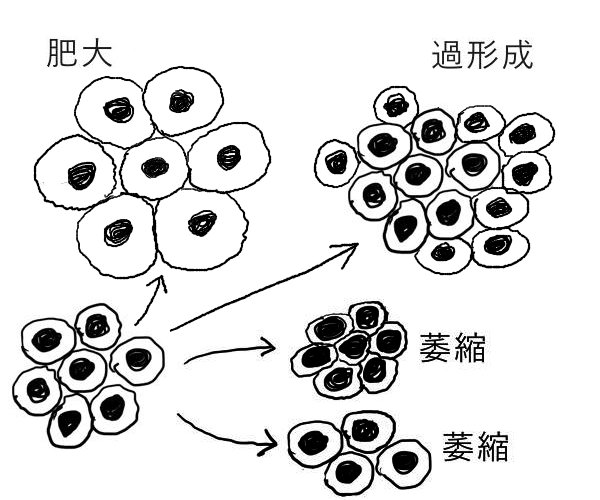
「適応」の種類には 「肥大」「過形成」「萎縮」「化生」などがある。
肥大(hypetrophy):細胞の大きさが増大する。それによって臓器が大きくなる。
過形成(hyperplasia):刺激により、組織や臓器の細胞数が増加する。
萎縮(atrophy):細胞の数や大きさが減少し、組織や臓器が小さくなる。萎縮細胞は機能を消失することがあるが、細胞死には至らない。
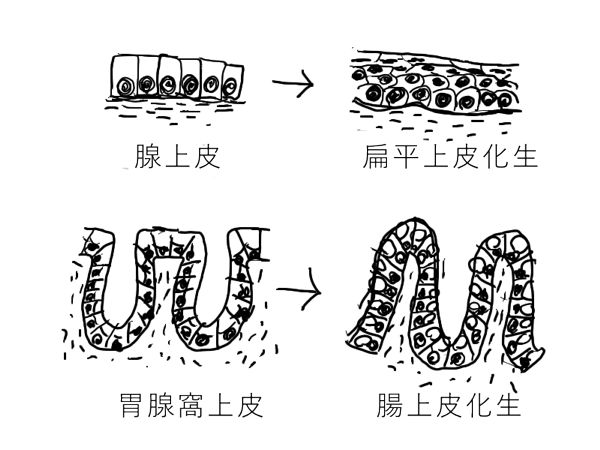
化生(metaplasia):一旦成熟したある細胞種が、ほかの細胞種に変化する。あるいは、ひとつの分化形質を示す細胞が他の分化形質を持つ細胞に変化する。
たとえば、気管は正常では線毛上皮でおおわれているが、炎症が持続すると扁平上皮がおおうようになる(扁平上皮化生と呼ぶ)。胃粘膜には正常では胃腺窩上皮があるが、慢性胃炎では小腸上皮が見られるようになる(腸上皮化生と呼ぶ)。
適応限界を越えた時に「細胞傷害(cell injury)」が起こる。
傷害が可逆的(「可逆的な細胞傷害」)のときは元に戻る。
傷害が非可逆的(「非可逆的な細胞傷害」)のときは「細胞死(cell death)」に至る。
「細胞傷害」の原因にはいろいろなものがある。
酸素欠乏、化学物質、感染性物質、免疫反応、遺伝子異常、栄養障害、物理的刺激、老化などにより細胞は傷害される。
これらの原因によるストレスの程度により、可逆的から非可逆的までの細胞傷害がおこる。
これらの原因を内因と外因に分ける考えがあった。たとえば・・・
内因:代謝異常、遺伝子異常、免疫異常、加齢、など
外因:生物学的因子、物理学的因子、化学的因子、栄養学的因子、社会的因子、など
しかし、ひとつひとつの病気の原因や起こるしくみが詳細にわかってくると、内因と外因にわける意味がなくなってきた。内因とされた多くのものがなんらかの外的因子による障害(遺伝子の傷害や異常な反応)であることが解明されてきたのである。
「細胞死」には主に2つのタイプがある。「壊死(necrosis)」と「アポトーシス(apoptosis)」である。
(1)「壊死(necrosis)」:
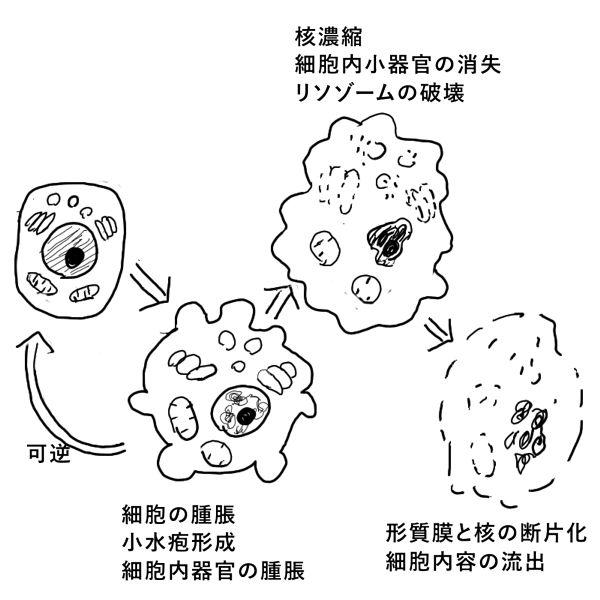
「可逆的な細胞障害」のときに最初に観察される現象は、「細胞腫脹(cellular swelling)」である。そして、脂肪蓄積、形質膜の小疱形成、微絨毛の消失、小胞体の拡張、ミトコンドリアの腫脹がみられる。これらの変化は、正常に戻りうる変化である。
「非可逆的な細胞傷害」を受けて細胞は「壊死」となる。細胞には、「細胞膜の完全性の消失」「細胞質内小器官の酵素作用による消失」「細胞内容の漏出」がみられる。
細胞が「壊死」に陥ったとき、漏出した細胞内容に対して炎症が起こる。
壊死にいたる細胞傷害のメカニズム
細胞が壊死に至る傷害のメカニズムには以下のようなものがある。
*ATPの枯渇:
ATPが過度に欠乏しエネルギー不足になることによって、細胞には以下のような致命的な影響が出る。(1) 細胞膜にあるエネルギー依存性ナトリウムポンプの活動が低下し、細胞内にナトリウムが蓄積し、カリウムが流出する。その結果、浸透圧が下がり、水が細胞質内に流入し、細胞が腫脹する。(2) ATP以外のエネルギー源を確保しようと嫌気性解糖が行われて、グリコーゲンが急速に減少する。乳糖が蓄積され、細胞内pHが下がり、細胞内酵素の活性が低下する。(3) カルシウムポンプが動かなくなる。(4) 長期化すると粗面小胞体からリボソームが分離し、タンパク質合成が低下する。
*ミトコンドリアの損傷と機能障害:
ミトコンドリアの損傷により、ATPの枯渇、活性酵素(フリーラジカル)の形成がおこり、細胞が傷害される。また、アポトーシスがおこる原因にもなる。
*カルシウムの流入:
虚血などのストレスによって、細胞質小器官内(ミトコンドリアやER)のカルシウムイオンが細胞質基質に放出されたり、細胞外からのカルシウムイオンの流入があったりすると、細胞質基質内のカルシウムイオン濃度が上昇する。カルシウムイオン濃度の上昇によって、ホスソリパーゼ(膜損傷)、プロテアーゼ(膜・細胞骨格損傷)、エンドヌクレアーゼ(DNA・クロマチン損傷)、ATP分解酵素(ATPの分解・減少)などの各種酵素が活性化され、これらが細胞を傷害する。また、ミトコンドリアの機能障害もおきる。
*酸化ストレス:
活性酸素種(reactive oxygen species, ROS)が大量に発生すると、脂質膜を過酸化したり、タンパク質の架橋を促進して酵素活性を下げたり、タンパク質を切断したり、DNAを損傷したり、などいろいろと細胞を傷害する。
活性酸素種は、紫外線やX線の照射で水から発生し、ある種の化学物質の代謝で増加することが知られている。活性酸素種は、主にミトコンドリアやエクソソームで発生する。
活性酸素種は、白血球が殺菌のために産生したり、細胞内のある種のシグナル伝達に関与したり、正常機能における役割も持っている。正常では細胞傷害をおこさないように細胞内濃度が厳密に制御されており、活性酸素種を除去する機構がいろいろと発達している。
*膜透過性の障害:
いろいろな細胞傷害において、細胞膜の損傷がおこり、その結果として細胞死に至る。
以上のような細胞の機能障害・機能異常により、細胞は「壊死」に陥るのである。
壊死組織の形態的パターン
壊死に陥った組織は形態的なパターンから、凝固壊死と融解(液状)壊死の2つに大きく分類される。
凝固壊死: 死んだ組織の構造が、少なくとも数日そのまま残る。硬い塊となる。
融解(液状)壊死: 死んだ細胞が完全に消化(液化)され、柔かい物質となる。死んだ組織が白血球などで溶かされた場合や、脳組織が虚血で壊死に陥った場合に見られる。
特殊な壊死のパターン
いくつかの特殊な壊死の形態パターンがある。
壊疽性壊死: 黒色を呈する壊死のこと。「乾性壊疽」は壊死組織の水分が蒸発したもの。凝固壊死の一種である。ミイラなどでみられる。「湿性壊疽」は壊死部に感染が加わったもの。融解壊死の一種である。
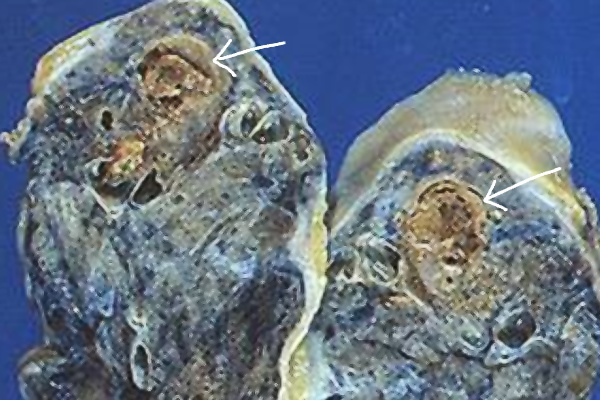
乾酪壊死: 結核感染で見られる類上皮細胞肉芽腫の中心に見られる壊死のこと。肉眼像が乾酪(チーズ)に似ている。凝固壊死の一種である。
脂肪壊死: 脂肪組織が死ぬと、不透明な白色調の黄色をした硬い塊をつくる特徴的な肉眼像を呈することから、特にこう呼ばれる。凝固壊死の一種である。
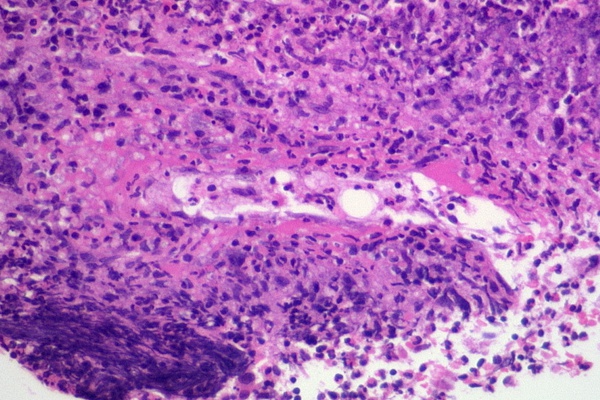
フィブリノイド壊死: 血管壁が免疫反応で傷害された時に見られる壊死のこと。HE染色でピンク色の無構造物が沈着する特有の組織像を示す。
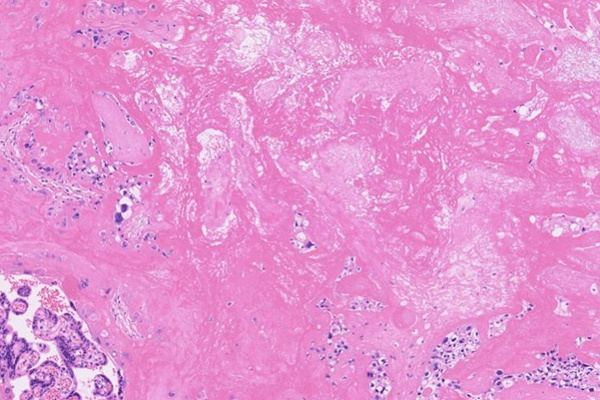
凝固壊死 [虚血性の壊死に陥った胎盤。壊死した部分に絨毛の形がうっすら残っている]

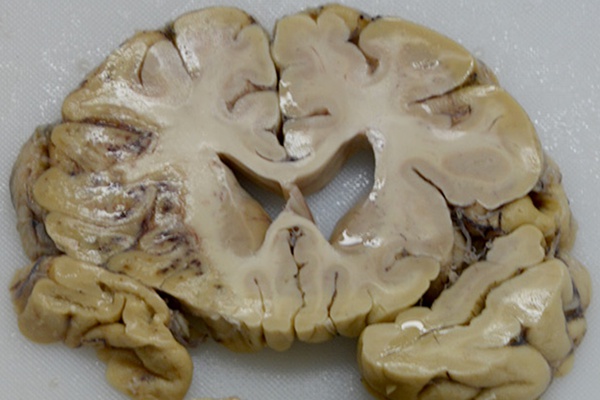
液状壊死 [虚血性の壊死に陥った大脳(左端領域)。壊死の部分は触ると柔らかい]
乾酪壊死 [結核の類上皮細胞肉芽腫の中央部の壊死。肉眼的にチーズ様とされる]
フィブリノイド壊死 [血管壁がHE染色で特徴的に一様にピンク色に壊死に陥っている。リンパ球が多数伴っている]
(2)「アポトーシス(apoptosis)」:
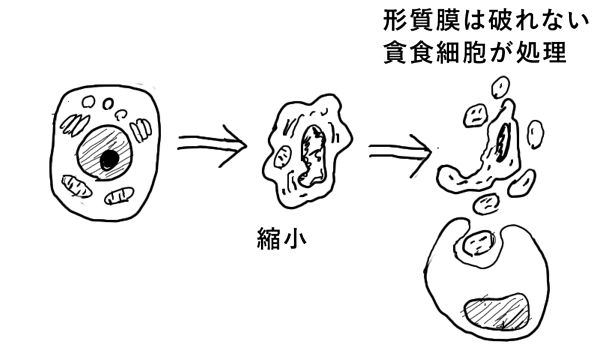
アポトーシスとは、厳密に制御された自殺プログラムによって誘導される細胞死のことである。
病的な時だけではなく、生理的にいつも起こっている現象であり、不必要な細胞や損傷細胞を除去するしくみである。
病的な時としては、DNA損傷がおこった細胞を除去する時、タンパク質合成時におりたたみ不全をおこしたタンパク質が小胞体に蓄積した時、ウィルスに感染した細胞を除去する時、などにおこる。
アポトーシスでは、核内DNAや細胞質・核内たんぱく質を分解する酵素が活性化され、細胞の断片が剥がれ落ちていき、「枯れ落ちる」外観をしめす。細胞膜が無傷なままで細胞成分が剥がれ落ち、剥がれ落ちた細胞成分はマクロファージに貪食される。
細胞の内容が細胞外に漏出する前に除去されるので、炎症が起こりにくい。
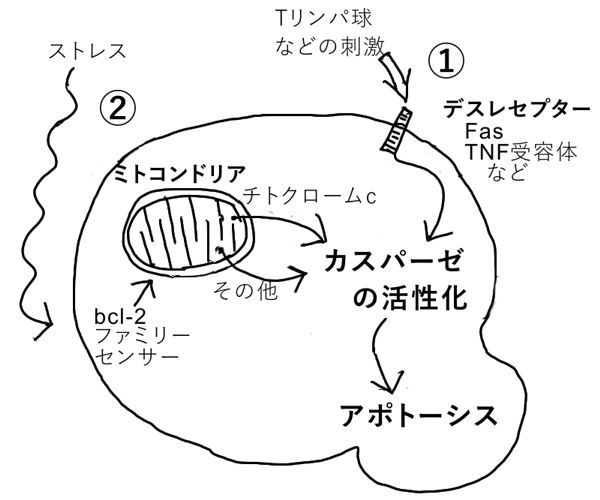
アポトーシスは、細胞内の「カスパーゼ」が活性化され、たんぱく質やDNAを切断することで開始される。アポトーシスがおこる時のカスパーゼが活性化される経路は二つある。
(1) 細胞表面の特定の受容体(デス・レセプターと呼ばれる(Fas、TNF受容体など))がTリンパ球などによって刺激されることを契機に、カスパーゼが活性化される経路。
(2) ミトコンドリアにアポトーシスを誘導する物質(チトクロームcなど)が含まれており、正常ではbcl-2ファミリータンパク質によって制御されている。細胞外部からのストレスでこの制御が乱れ、ミトコンドリアから細胞質内に誘導物質が流出し、カスパーゼが活性化される経路。
老化(senescence)とは、人の余命が短くなっていくこと、細胞の能力が減衰していくこと、である。いくつかのメカニズムが関与していると考えられている。
DNA損傷
DNAの損傷は通常人体にそなわったDNA修復機構によって修復されるが、修復されなかった致命的でない損傷DNAの蓄積が、老化に関与していると考えられている。
血液幹細胞には、年間14ヶ所の遺伝子変異が加わっていっているというデータがある。
ウェルナー症候群は、白髪、禿頭、皮膚のしわ、白内障、動脈硬化、糖尿病など高齢でみられる病気が若年から見られる病気である。老人でみられるような遺伝子変異の蓄積が若年からみられるのである。常染色体劣性遺伝病であり、8番染色体上にあるWRN遺伝子の変異があり、RecQ型のDNAヘリカーゼ(WRNヘリカーゼ)(DNAが複製する特に二重らせんをほどく働きをするタンパク質)に異常がある。DNAヘリカーゼの異常がどのようなメカニズムで遺伝子変異の蓄積を早めるかについては不明な点が多いが、現在いろいろと研究が行われている。
細胞の複製機能低下
すべての正常な細胞は分裂回数に限りがある。細胞分裂回数が上限に達すると、細胞は末期の非分裂状態になって分裂を停止する(複製老化)。複製老化に達した細胞の増量が、個体レベルでの老化に関与している。小児から採取した細胞を培養すると、高齢者から採取した細胞に比べて多くの回数の分裂を行うことが出来る。
細胞分裂の回数に限りがある現象には「テロメア(telomere)」が関与している。
「テロメア」とは直線状の染色体末端に存在するDNAの短い反復配列のことである。テロメアが存在することで染色体末端の完全な複製が可能となっており、また、テロメアは染色体末端を融合や分解から保護する役割を果たしている。
正常な細胞が細胞分裂する際、テロメアの一部が複製されないままに分裂していくため、分裂するたびにテロメアは短縮していく。テロメアが極端に短くなった場合、細胞周期を停止するシグナルが伝わる。
テロメアを伸張させるテロメラーゼ(telomerase)という酵素があるが、テロメラーゼは生殖細胞では認められるが、幹細胞でわずかに観察される程度であり、ほとんどの正常な体細胞では認められない。
p16(INK4a)が老化に関与しているといわれている。P16は、組織の老化に伴って血中で飛躍的に上昇する。p16は、細胞周期のG1からS期への進行を抑制的に制御しているタンパク質であり、p16の上昇は細胞複製能を低下させる方向に働いているのではないかと考えられている。
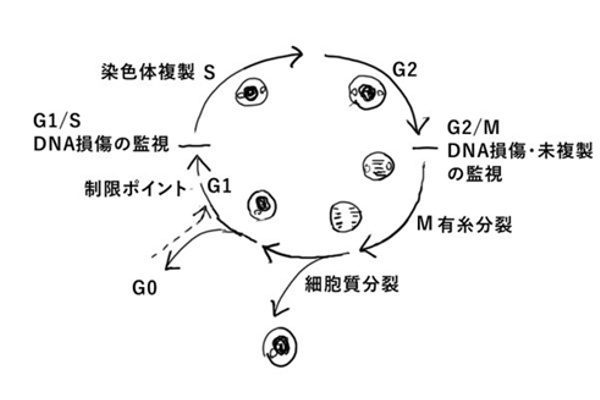
タンパク質の恒常性の欠陥
タンパク質合成の際には、正しく折りたたまれたタンパク質を維持し、間違った折りたたみをおこしたタンパク質を排除する機構がある。高齢化とともにこの機構に欠陥が出てくることが老化に関与するといわれている。折りたたみ不全のタンパク質が小胞体に蓄積するとアポトーシスを誘導する。
栄養感知の制御不全
カロリー制限が長寿と関係するといわれている。
カロリー制限でsurtuins(サーチュイン, Sirt)が活性化される。サーチュインは長寿遺伝子と呼ばれる。サーチュインは、酵母Sir2(silent information regulator-2)の哺乳類ホモログであり、Sirt1 からSirt7 まで同定されている。
酵母では、Sir2を欠損させると寿命が短縮し、過剰発現させると寿命が延長する。酵母Sir2は、ヒストン脱アセチル化酵素であり、「リボソームRNA反復遺伝子群」(同じ遺伝子が100回以上繰り返して存在し、老化と共にコピー数が激しく変動する遺伝子群)の安定化のために働いている。「リボソームRNA反復遺伝子群」を人為的に不安定化させると酵母の寿命は短くなり安定化させると寿命は延長した。現在は酵母Sir2に近いされる哺乳類のSirt1についてマウスなどで様々な研究が行われている。
インスリン/インスリン増殖因子-1(IGF-1)経路の抑制が長寿をもたらすことが知られている。線虫にはインスリン/IGF-1受容体を作るdaf-2という遺伝子があるが、daf-2遺伝子の変異によるインスリン/IGF-1経路のシグナル低下が線虫の寿命を約2倍に延長することが知られている。また、ハエでもインスリン/IGF-1受容体の遺伝子変化が寿命を延ばすことが知られている。
こうした糖代謝関係の経路が寿命に関連する点が注目されている。
[2020.6.]
細胞や組織が正常に機能するためには、血液が正常に体内を循環することが必要である。
血液が循環することで、細胞や組織に酸素が供給され、老廃物が除去され、体液の恒常性(homeostasis)が保たれる。
体脂肪を除いた体重の約60%は水分である。体内水分の2/3は細胞内に存在する。残り1/3の細胞外液の約80%が間質液として存在し、細胞外液の約20%(全水分の約5~7%)が血漿(血液の液体成分)として存在する。血漿成分は血液の55%を占め、45%は赤血球・白血球である。
循環が障害されるしくみには、浮腫、充血、うっ血、虚血、梗塞、血栓症、塞栓症、などがある。
「浮腫」とは、血管外の間質組織間隙に水分が増加することを言う。
浮腫がおこると、以下のような病態となる。
皮下浮腫: 皮下に浮腫がおこり、皮膚の隆起と腫脹がみられる。
肺水腫: 肺胞腔内に漏出液が溜まり、呼吸困難に陥る。肺重量は増す。
脳浮腫:脳に浮腫がおこると、脳が腫脹する。腫脹した脳が頭蓋内に納まりきれなくなった場合、脳は大後頭孔からはみ出て、脳ヘルニアとなる。
胸腔に溜まった水分を胸水(hydrothrax)、心嚢腔に溜まった水分を心嚢水(hydropericardium)、腹腔内に溜まったものを腹水(ascites)という。
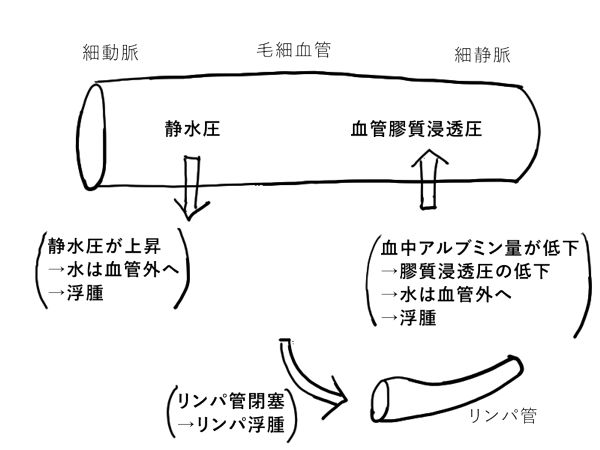
「漏出液(transudate)」とは、タンパク質濃度が低い水分である。血管静脈圧と血漿膠質浸透圧力のアンバランスによって間質組織間隙に増加する水分である。
血管内腔と間質組織間隙との水分の移動は、血管静脈圧と血漿膠質浸透圧という逆向きの力で調節されている。毛細血管静水圧上昇で水分は血管外へ移動する。血漿膠質浸透圧上昇で水分は血管内へ移動する。
正常では、水分は末梢細動脈で間質組織間隙に流出し、末梢細静脈で血管腔内へ流入している。少量の余分な水分がリンパ管により排出されている。
血管静脈圧の亢進あるいは血漿膠質浸透圧低下がおこると、血管静脈圧と血漿膠質浸透圧のバランスが崩れ、間質組織間隙に漏出液が大量に流出する。そして、水分が間質組織間隙に貯留して浮腫となる。
静脈圧の亢進の原因として静脈の還流障害、心不全がある。こうした場合に浮腫がおきる。
血漿膠質浸透圧は主にアルブミン(タンパク質)の濃度によって生じる。つまり、アルブミン喪失(ネフローゼ症候群など)、アルブミン合成低下(肝臓の障害、タンパク質栄養障害など)が原因で、血漿膠質浸透圧低下がおこり、浮腫となる。
また、リンパ管閉塞によって、リンパ管からの排出が低下すると、浮腫になる。
リンパ管閉塞は原因でおこる浮腫を、「リンパ浮腫(lymphedema)」と呼ぶ。通常限局性の浮腫となる。
ナトリウム貯留は全身性の浮腫の原因となる。
ナトリウムが貯留すると水が貯留するため全身の循環血液量が増加し、静脈圧が上昇と血漿膠質浸透圧低下がおこり、全身性の浮腫となる。
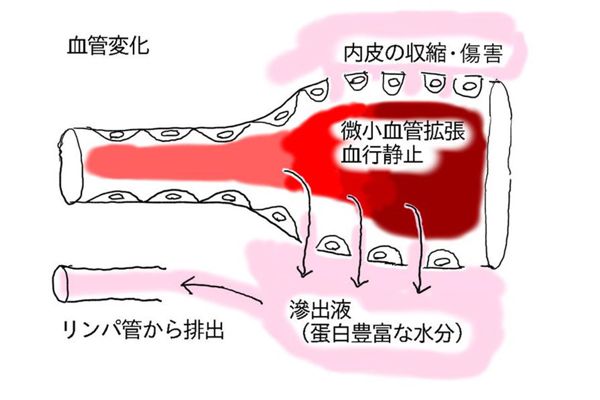
浸出液による浮腫については炎症の項目で説明する。
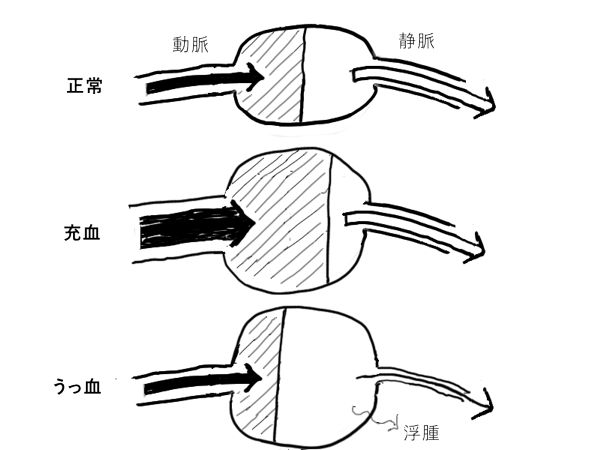
「充血」とは、細動脈拡張により組織血流が増加し、動脈血が満ちる状態のこと。充血した部位は紅潮する。
「うっ血」とは、組織からの静脈還流量の低下により生じる血液が満ちる状態のこと。うっ血した部位は暗赤色調となる。一般に、静水圧が上昇するため、浮腫が同時に起こる。
「出血」とは血液が血管外に流出すること。
「血腫(hematoma)」とは、出血によりできた組織内での血液の塊のこと。
「血胸(hemothrax)」とは、出血によりおこった胸腔内への大量の血液貯留をいう。腹腔内への大量の血液貯留は血腹と言わずに「大量の腹腔内出血」という。
総血液量の20%が急速に出血しても、またそれより大量でもゆっくりとした出血ならば健常成人に対する影響はほとんどない。
成人男子(約60kg)の総血液量の20%は、約1リットルである。
急速な大量の出血はショック(全身の循環不全)をおこすことがある。
総血液量の50%を失うと死に至るとされる。
成人男子(約60kg)の総血液量の50%は約2.5リットル。
アスファルト上では、200 mlの出血は直径50 cm程度に拡がり、500 mlでは直径約1 mに拡がります。
正常な止血についての詳細な説明は省くが、下記のような事項がある。
(1) 内皮細胞は正常では血液凝固抑制に働くが、活性化されて血液凝固促進能を示す。
(2) 血小板により血液凝固がおこる
(3) 凝固因子により血液凝固がおこる
「血栓(thrombus)」とは、血管腔内の凝血塊のことである。
血栓形成(血管腔内で血液凝固が起こること)に影響する要素が主に3つある(ウィルヒョーの三要素)。
(1) 内皮細胞障害。
(2) 血行静止あるいは乱流。
(3) 血液凝固能亢進。
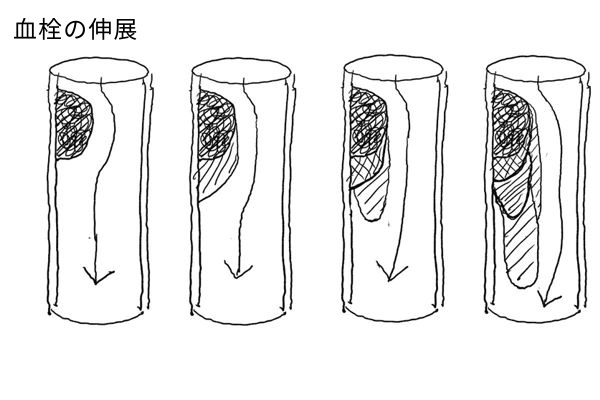
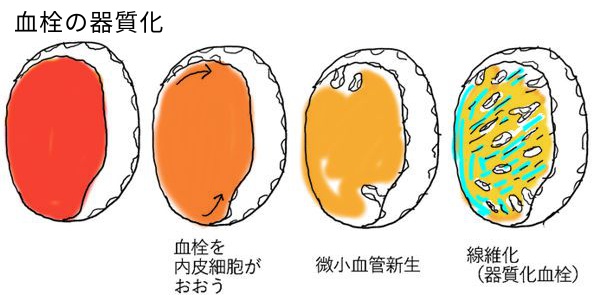
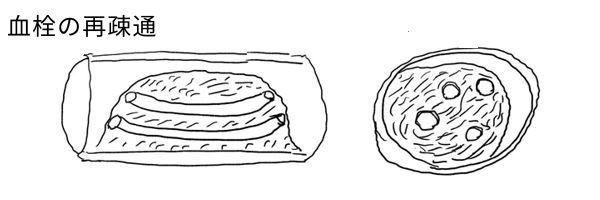
形成された血栓(血管内の凝血塊)は以下のように経過していく。
(1) 伸展(血管中を血栓が大きくなっていく)
(2) 塞栓形成(血栓が遊離し血管系のほかの場所に運ばれる)
(3) 溶解(線維素溶解作用により取り除かれる)
(4) 器質化と再疎通(血栓が線維化に陥る、そして線維化内に内腔が再び形成される)
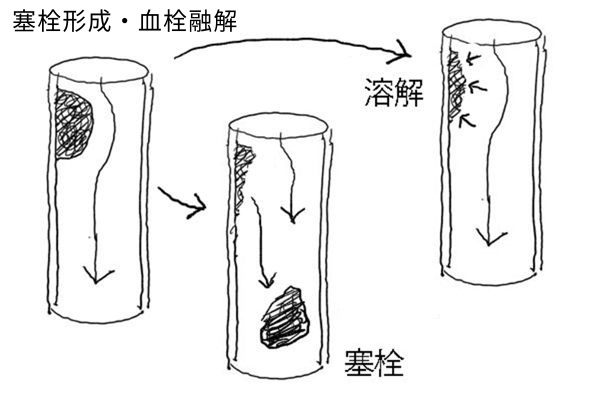
「塞栓(embolus)」とは、固体、液体あるいは気体からなる血管内遊離物で、血流により産生部位から離れたところに運ばれる。
肺血栓塞栓症 (下肢の静脈にできた静脈血栓が、肺動脈に運ばれる。肺での酸素交換ができなくなり呼吸困難がおこる)
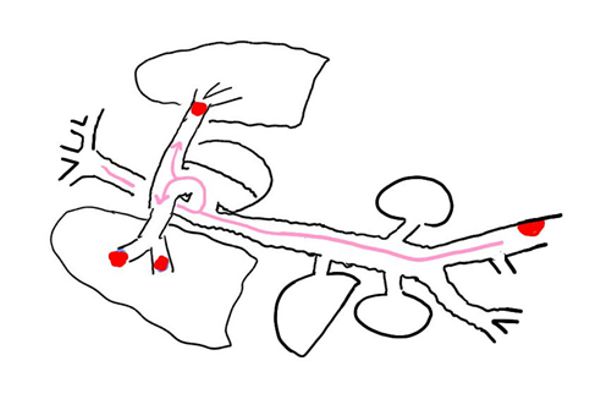
全身性血栓塞栓症 (心臓内の壁在血栓が全身に運ばれる。全身のいろいろな臓器の動脈に血栓がつまり、血流障害をおこす)
脂肪塞栓症 (骨折など外傷後に脂肪滴が、いろいろな部位に運ばれる。動脈に脂肪組織片がつまり、血流障害をおこす)
空気塞栓症 (気泡が血管閉塞を引き起こす。誤って空気を注射するとおきる(医療事故)。水中など高圧環境で作業する者が急に低圧環境(水上や地上)に戻ったとき,血液に溶け込んだ窒素が気泡化しておこる(潜函病・潜水病という)。100mlの気体が血管内入ると症状がでる)
羊水塞栓症 (分娩時に羊水が母体循環に入るとおこる。低血圧性ショックを起こす)
コレステロール塞栓 (大動脈の粥状硬化症の粥腫からコレステロール結晶が全身に運ばれる。全身のいろいろな臓器の動脈に血栓がつまり、血流障害をおこす)
細菌塞栓症(敗血症性塞栓症) (細菌が血流に乗って移動し、いろいろな臓器に感染巣をつくる)
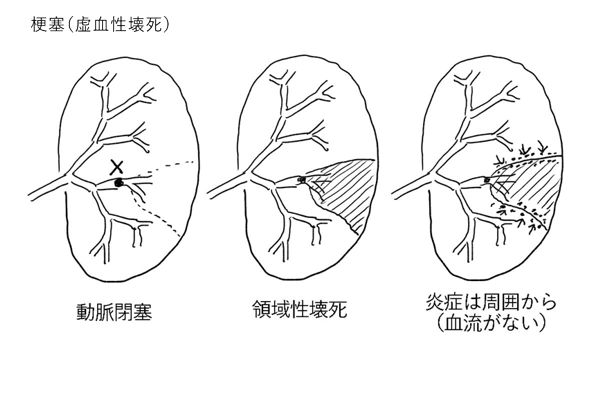
「梗塞」とは、虚血性壊死を起こすことである。動脈血の供給(あるいは静脈血の排出)が遮断され、低酸素により細胞が壊死に陥るのである。大部分が動脈閉塞によって起こる。梗塞をおこす動脈閉塞の原因の大部分は血栓症や塞栓症である。梗塞に陥った領域を「梗塞巣」という。
梗塞巣でも組織壊死に対する炎症反応がおきるが、そもそも血流がないため、浮腫や白血球の供給は梗塞巣の辺縁から徐々におこりだけであり、中央部にはなかなか炎症は及ばない。
「ショック」とは、原因にかかわらず全身の血流低下が引き起こされた状態のことをいう。低血圧、組織還流障害、細胞の低酸素状態が引き起こされる。
「ショック」はいろいろな原因で起こるが、主に、心原性、低容量性、敗血症性(エンドトキシン性)の3つの原因が重要である。そのほかにも、神経原性、アナフィラキシー性がある。
心原性: 心臓の血液拍出量の低下が原因で全身の血流低下が起こった場合。
低容量性: 血液や血漿の大量な減少が原因で全身の血流低下が起こった場合。
敗血症性(エンドトキシン性): 下記
神経原性: 脳や脊髄の急性傷害による全身の血管拡張が原因で全身の血流低下が起こった場合。
アナフィラキシー性: I型過敏症が全身性に高度におこったことが原因で全身の血流低下が起こった場合。免疫・過敏症の項目で解説される。
敗血症性ショックは、炎症性サイトカイン・カスケードによるショックである。
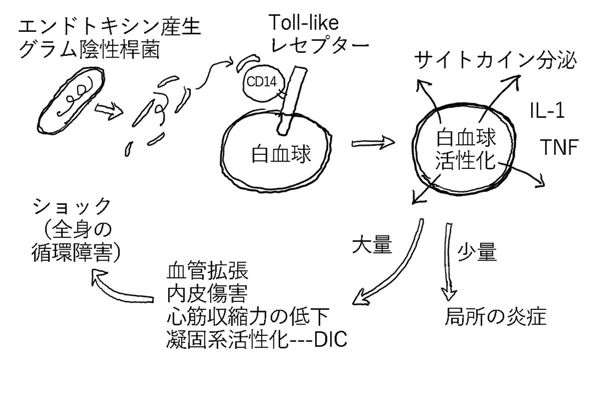
敗血症性ショックの大部分(約70%)が、エンドトキシン産生グラム陰性桿菌による。
エンドトキシン産生グラム陰性桿菌の細胞の外壁の主な構成成分であるリポ多糖類(LPS: lipopolysaccharide)がエンドトキシンである。
リポ多糖類は、細菌の死滅後に菌体から遊離して毒素活性を示す。
遊離したリポ多糖類は、血中でリポ多糖類結合タンパク質と複合体を形成し、単球、マクロファージ、好中球上に存在するレセプター(CD14)と結合する。CD14は細胞表面でToll-like レセプター4と複合体を形成しており、リポ多糖の複合体とCD14が結合するとToll-like レセプター4を介する細胞内シグナル伝達が起こる。それにより、細胞(単球、マクロファージ、好中球)は活性化し、いろいろなサイトカイン(TNF, IL-1など)を分泌する。このようにして、細菌から遊離したリポ多糖は炎症をおこす。
遊離したリポ多糖類が少量の場合は。局所に炎症がおきるだけである。リポ多糖類が多量の場合は、全身性の血管拡張、心筋収縮量の低下、広範な内皮細胞障害と活性化、凝固系の活性化による微小血栓形成(DIC)の影響が重なり、全身の血流低下(ショック)を来たす。最終的には多臓器不全にいたる。
[2020.6.]
[戻る]